オンコリス、世界初の食道がん局所治療薬「テロメライシン」を年内販売開始 高薬価を目指す戦略で収益化を推進
「2025年にご期待頂きたい事項」の結果

浦田泰生氏(以下、浦田):代表取締役社長の浦田です。当社は2004年の創業以来、腫瘍溶解ウイルス「OBP-301(テロメライシン)」の開発に邁進してきました。
おかげさまで、2025年12月15日に、「テロメライシン」の臨床試験、非臨床試験、品質に関するデータをすべてまとめ、計画どおり承認申請を行うことができました。
この腫瘍溶解ウイルス「テロメライシン」については、食道がんの局所治療薬として世界初の医薬品となります。
さらに、アデノウイルスを用いた腫瘍溶解ウイルスとして市場に出る第一号となる見込みです。このように、非常に意義深い時期を迎えており、みなさまにご報告できることを誇りに思っています。
スライドに記載のとおり、昨年度は、先駆け総合評価の事前相談を開始し、承認申請を行ったほか、オーファンの申請を行い希少疾患に対する治療薬の指定を受けました。また、再生医療等製品製造販売業の業許可取得や12か月安定性試験のクリアなどの項目を達成しています。
「テロメライシン」に関しては非常に大きな進捗を達成しましたが、「OBP-601」については、アメリカ合衆国の諸事情で、ライセンス先のTransposon社の資金調達がやや遅れたことから未達成に終わっています。それにもかかわらず、今年に入っていろいろな進捗があるとの報告を受けています。
このような状況の中で昨年末の決算を迎え、現在の状況をみなさまに詳しくご報告したいと考えています。それではまず、決算ハイライトについて樫原常務より報告します。
財政状態の概況
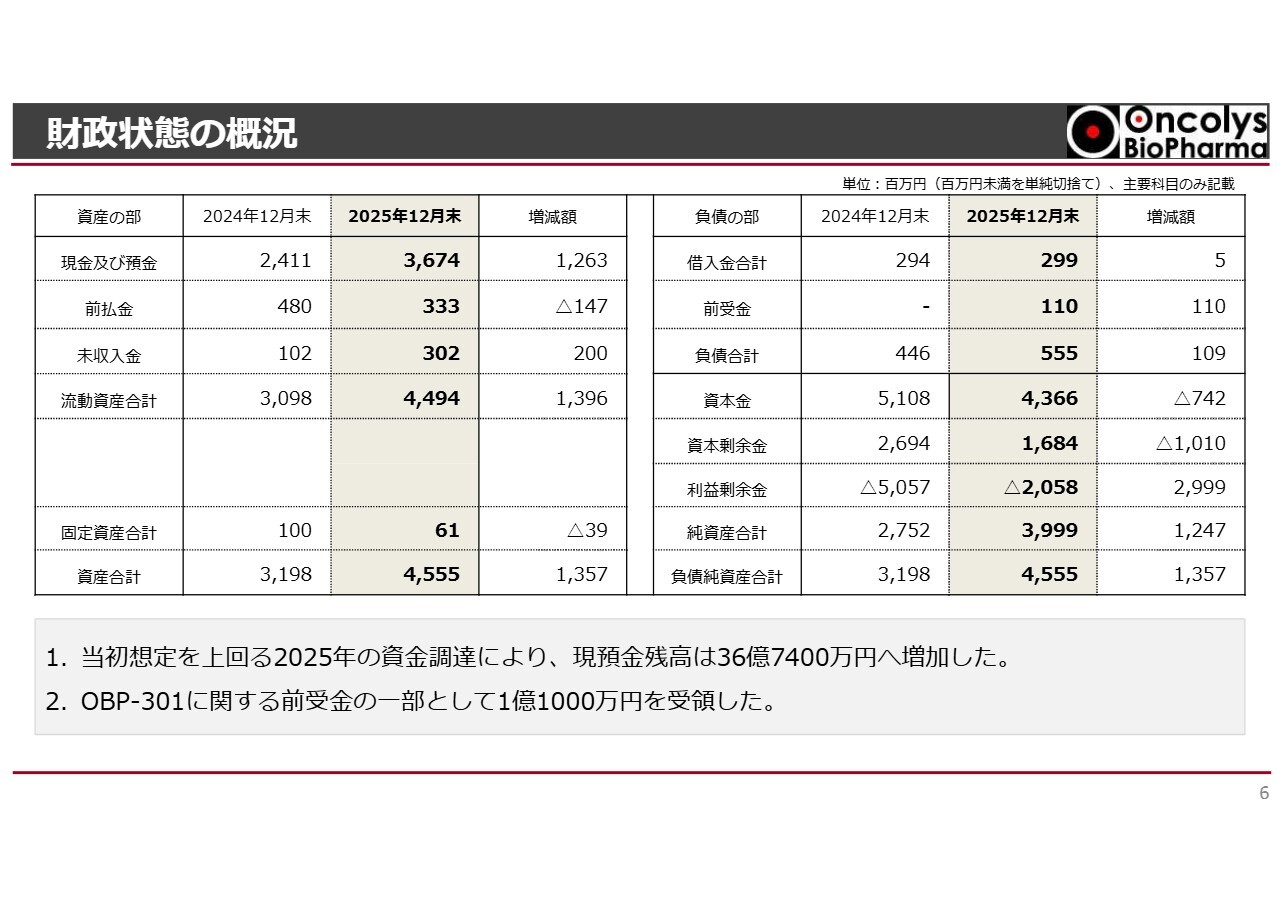
樫原康成氏(以下、樫原):常務取締役の樫原です。私からは、財政状態の概況についてご説明します。昨年度末の現金および預金は36億7,400万円となり、2024年12月末から12億6,300万円増加しました。
この増加は、2025年に行った資金調達が想定調達額を上回ったことによるものです。
また、富士フイルム富山化学から前受金として1億1,000万円を受領しました。これらの結果、純資産は2024年12月末から12億4,700万円増加し、財務状況が改善しました。
経営成績の概況
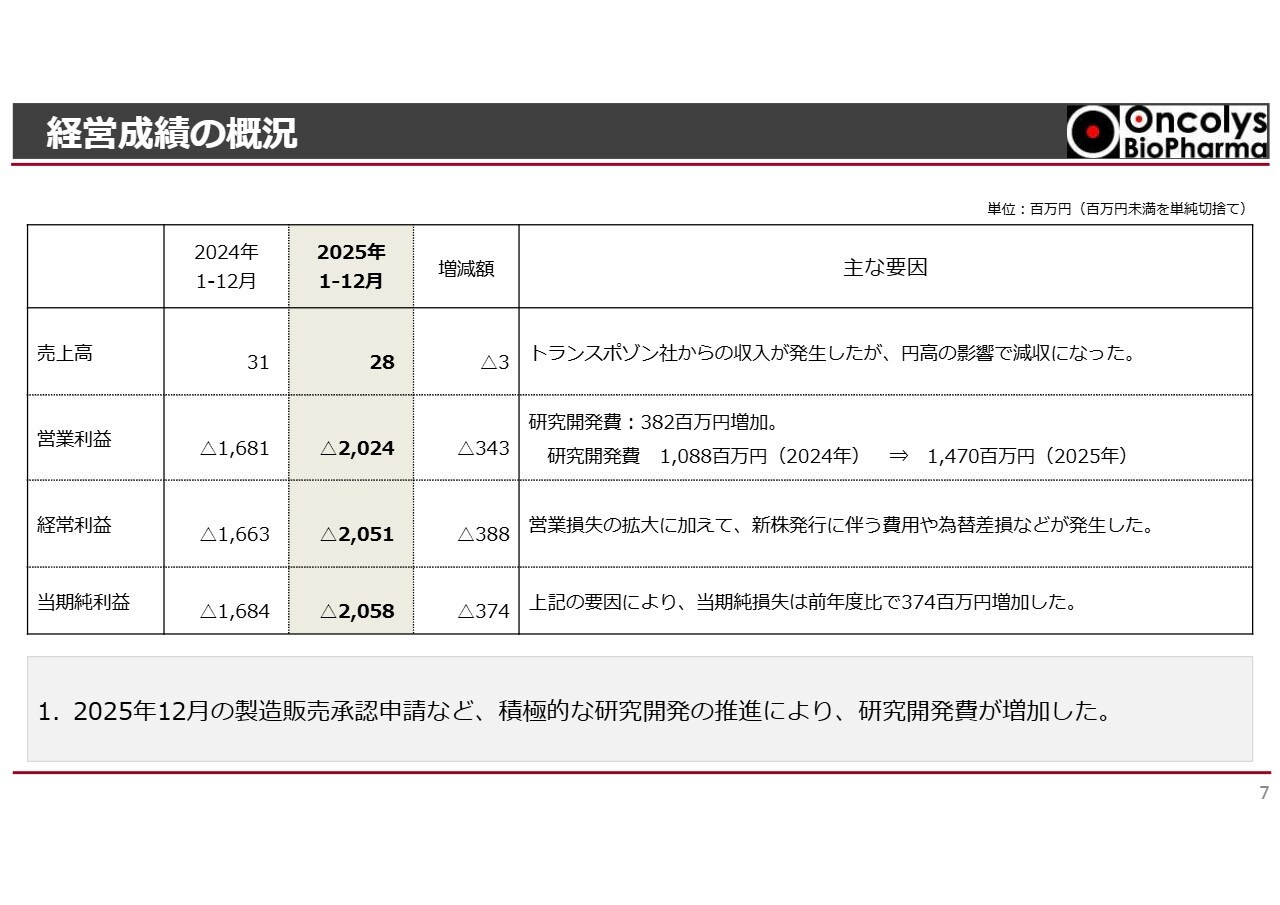
経営成績の概況についてご説明します。昨年度の売上高は2,800万円で、営業損失は20億2,400万円となりました。
先ほど浦田から説明がありましたように、12月にはOBP-301の承認申請を行いました。研究開発を積極的に進めた結果、研究開発費が3億8,000万円強増加しています。
その結果、最終的には当期純損失として20億5,800万円となりました。
キャッシュ・フローの概況
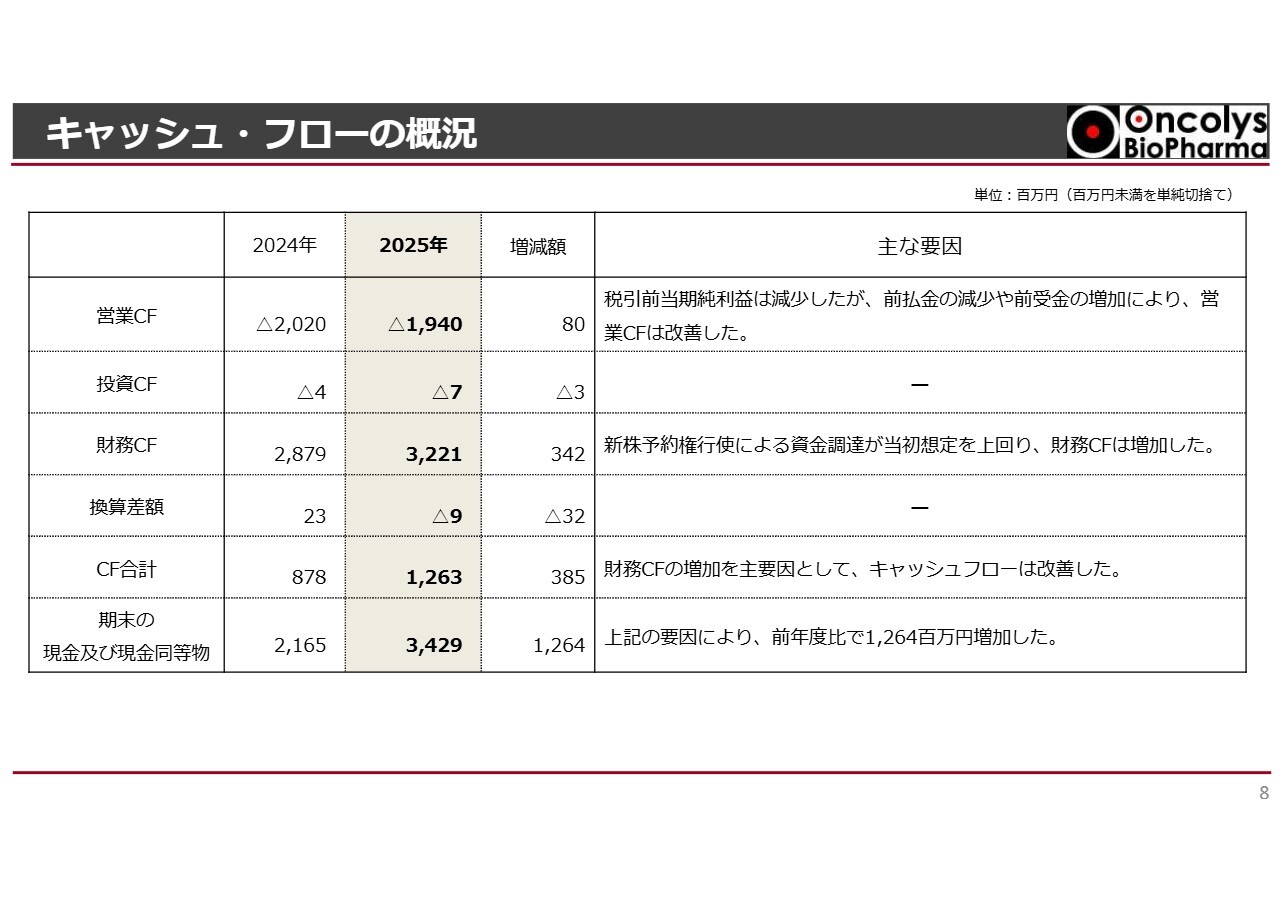
キャッシュ・フローの概況についてご説明します。営業キャッシュ・フローはマイナス19億4,000万円となっています。
税引前当期純利益は減少しましたが、前払金の減少や前受金の増加により、営業キャッシュ・フローは2024年度より改善しています。
また、昨年実施した資金調達が想定を上回ったことから、財務キャッシュ・フローはプラス32億2,100万円となっています。
それにより、期末の現金および現金同等物は34億2,900万円となっています。
2026年12月期の業績見通し

今期の業績見通しについてご説明します。今期は、昨年承認申請を行ったOBP-301の承認後の発売を見込んでいます。
これにより、「テロメライシン」の売上高が計上される見込みです。また、「テロメライシン」や「OBP-601」のマイルストーン収入も見込んでいます。
一方で、不確定要素が多いことから、今期の業績見通しについては開示を控えています。
定款変更の目的と事業資金に関する方針
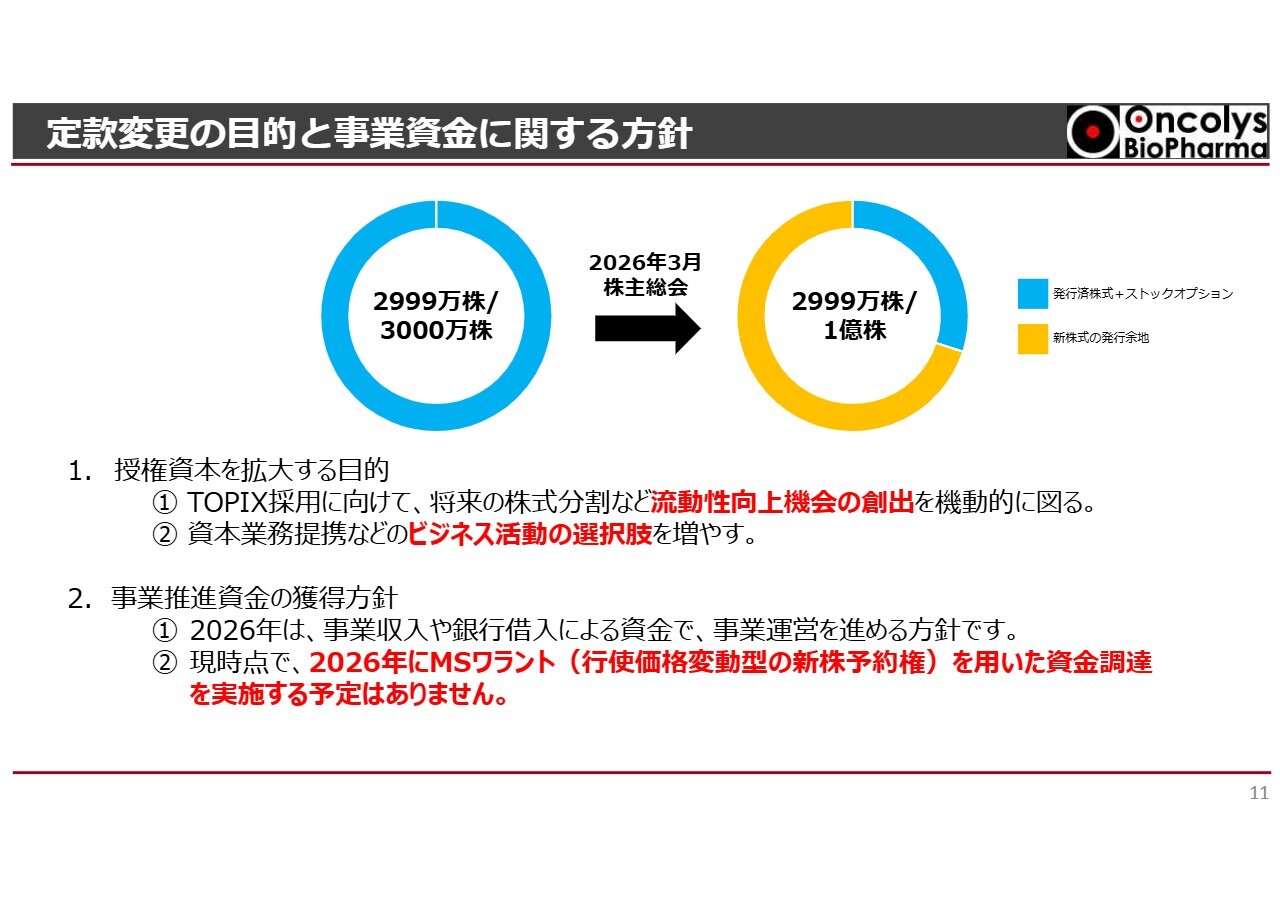
秦耕平氏(以下、秦):執行役員の秦です。私からは財務調達の方針について説明します。
本日発表したとおり、本年3月24日に予定しています株主総会へ、定款変更の議案を上程します。現状で3,000万株の授権資本を1億株まで拡大し、発行可能株式総数を増加させる予定です。
この発行株式数拡大の目的は、TOPIXへの採用を目指し、例えば将来の株式分割を視野に入れることで、流動性向上の機会を機動的に創出することです。
また、さまざまな企業との資本業務提携を通じて、当社が事業を進める上でビジネス活動の選択肢を増やすことも目的としています。
2026年の事業推進に必要な資金は、後ほど当社が説明します今期予定しているさまざまな事業収入や、本日同時に発表したみずほ銀行からの借入資金を活用し、事業運営を進めていく方針です。
現時点では、2026年にMSワラントを用いた資金調達を実施する予定はありません。
みずほ銀行からの新たな借入

先ほどお話しした、みずほ銀行からの借入について説明します。
昨年秋からみずほ銀行とさまざまな折衝を重ね、今年販売を開始予定の「OBP-301」に関する収入の一部を返済原資としています。4億4,000万円を無担保・無保証のコベナンツなしの借入として、2月に実行する予定です。
この借入により、先ほどお伝えした12月末時点で約36億円あった現預金残高に、4億4,000万円が加算されることになります。
当社は、MSワラントに依存することなく、さまざまな資金調達の選択肢を増やしていきたいと考えています。
2025年12月末のパイプラインの状況
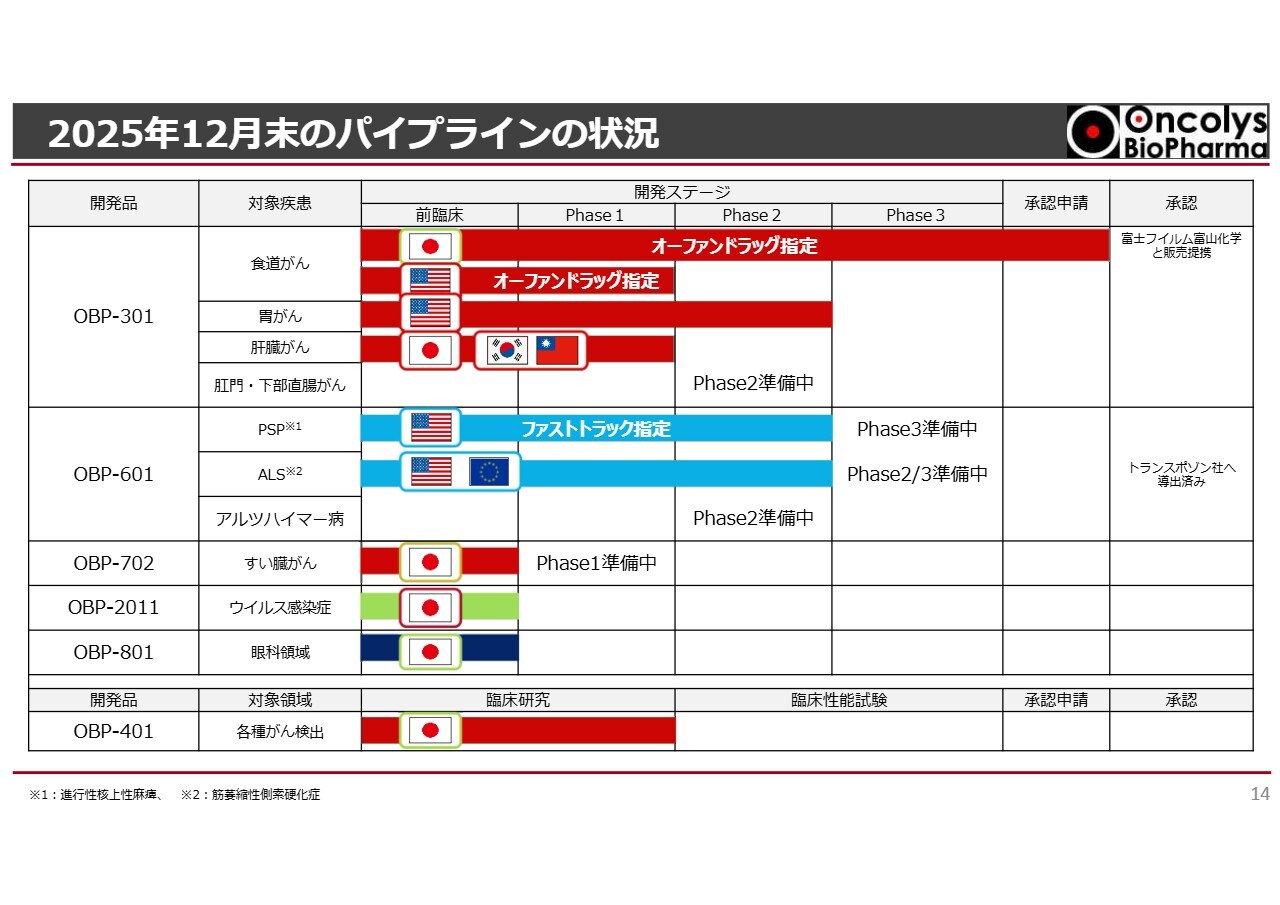
浦田:私からは主なパイプラインの状況についてご説明します。まず、「テロメライシン」の状況についてお話しします。
こちらのスライドは、当社のパイプラインの状況を示しています。やや情報量の多いスライドですが、上部の赤色の棒グラフが「テロメライシン」の状況を表しています。
一番上に記載されている食道がんは、日本国内でオーファンドラッグに指定されており、現在、承認申請が完了した段階にあります。
アメリカでもオーファンドラッグに指定されていますが、現在は胃がんの臨床試験が進められています。
また、青色の棒グラフが示しているのは、「OBP-601」という化合物で、Transposon社にライセンスアウトしたものです。すべてPhase2まで終了していますが、アルツハイマー病に関しては、今後Phase2が進んでいく可能性があります。
さらに、第2世代の「テロメライシン」である「OBP-702」も、治験開始の準備が進められています。
Waterfall Plot:3回目投与時以降のbest response
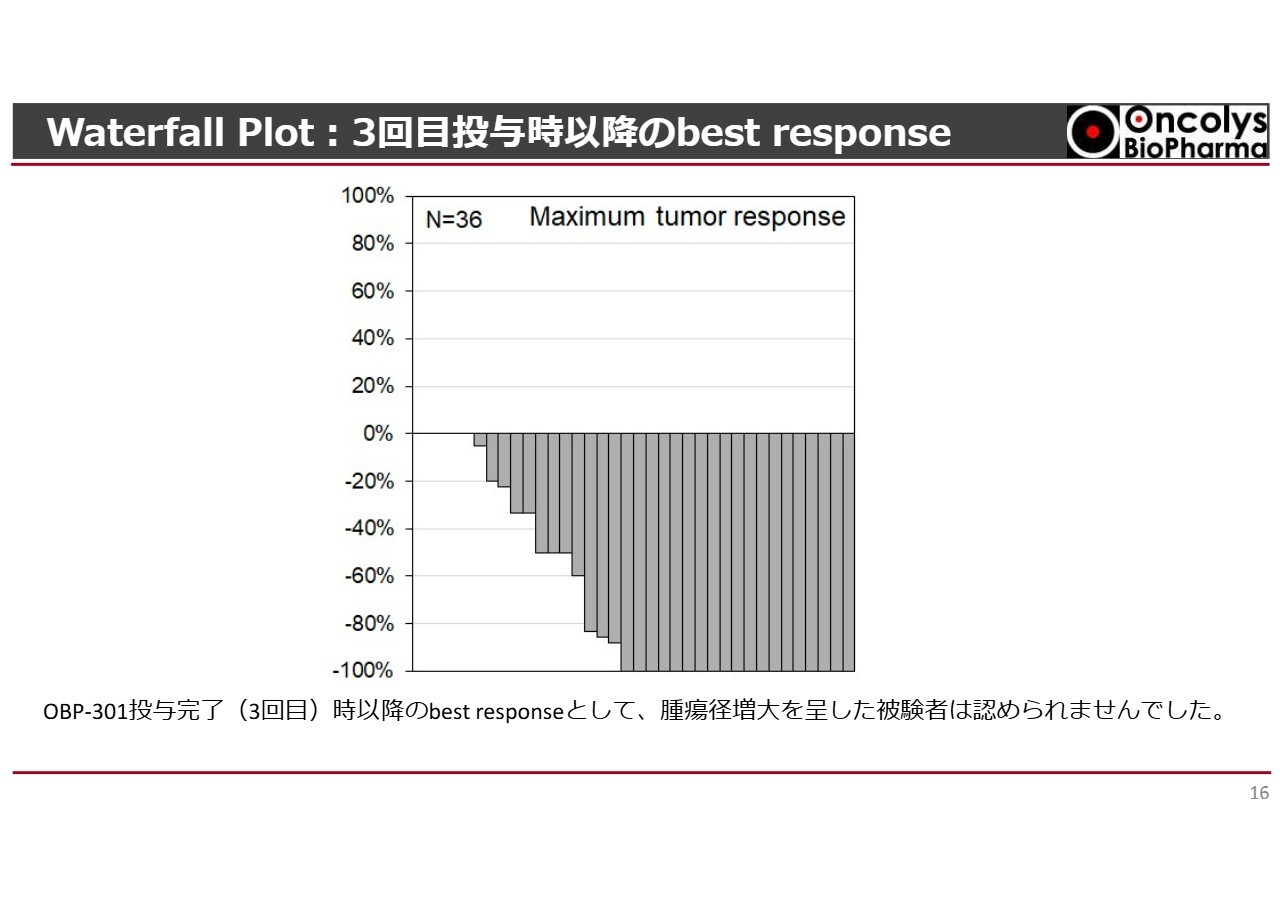
これまで何度もお話ししてきた「テロメライシン」についてです。スライドのグラフは、各症例で食道がんの大きさがどのように縮小していったかを示しています。
このように、半数以上の症例でがんが100パーセント消失しているという結果が得られました。
食道がん放射線併用Phase2試験有効性
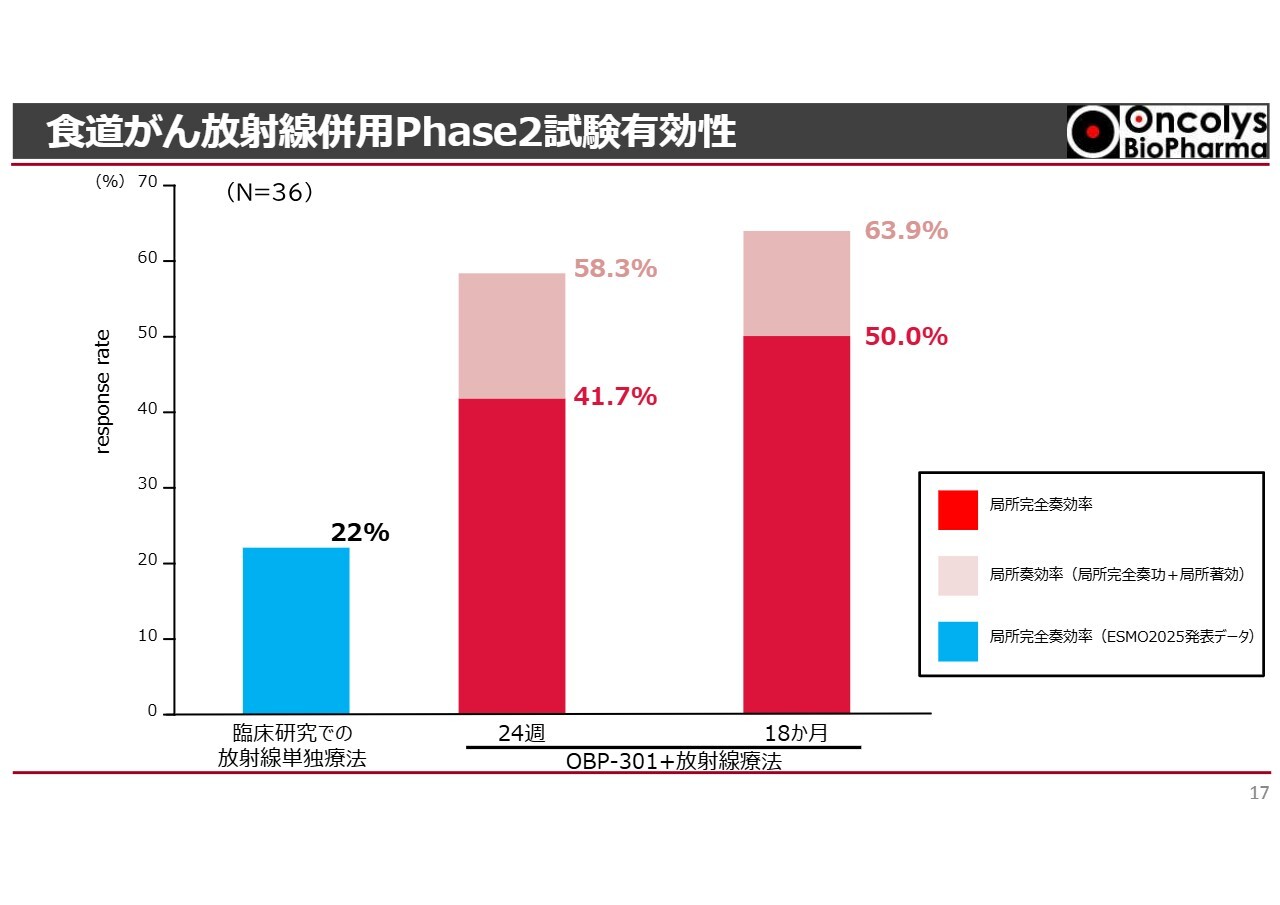
スライドの赤色の棒グラフは、先ほどの結果をもとに、投与後24週から18ヶ月後の完全奏効率を示しています。
左側の青色の棒グラフは、過去に当社が臨床試験を実施した施設で行われた放射線単独療法による食道がんの消失率です。歴史的に見ると、消失率は22パーセントでした。
しかしながら、「テロメライシン」との併用により、完全奏効率が24週で41.7パーセント、18ヶ月目には50パーセントに向上しました。
また、がんが著しく小さくなった症例を含めると、18ヶ月目で約64パーセントとなっています。
このように、非常に顕著な臨床結果が得られました。これが厚生労働省でこれから審査されるデータになります。
OBP-301の生存率
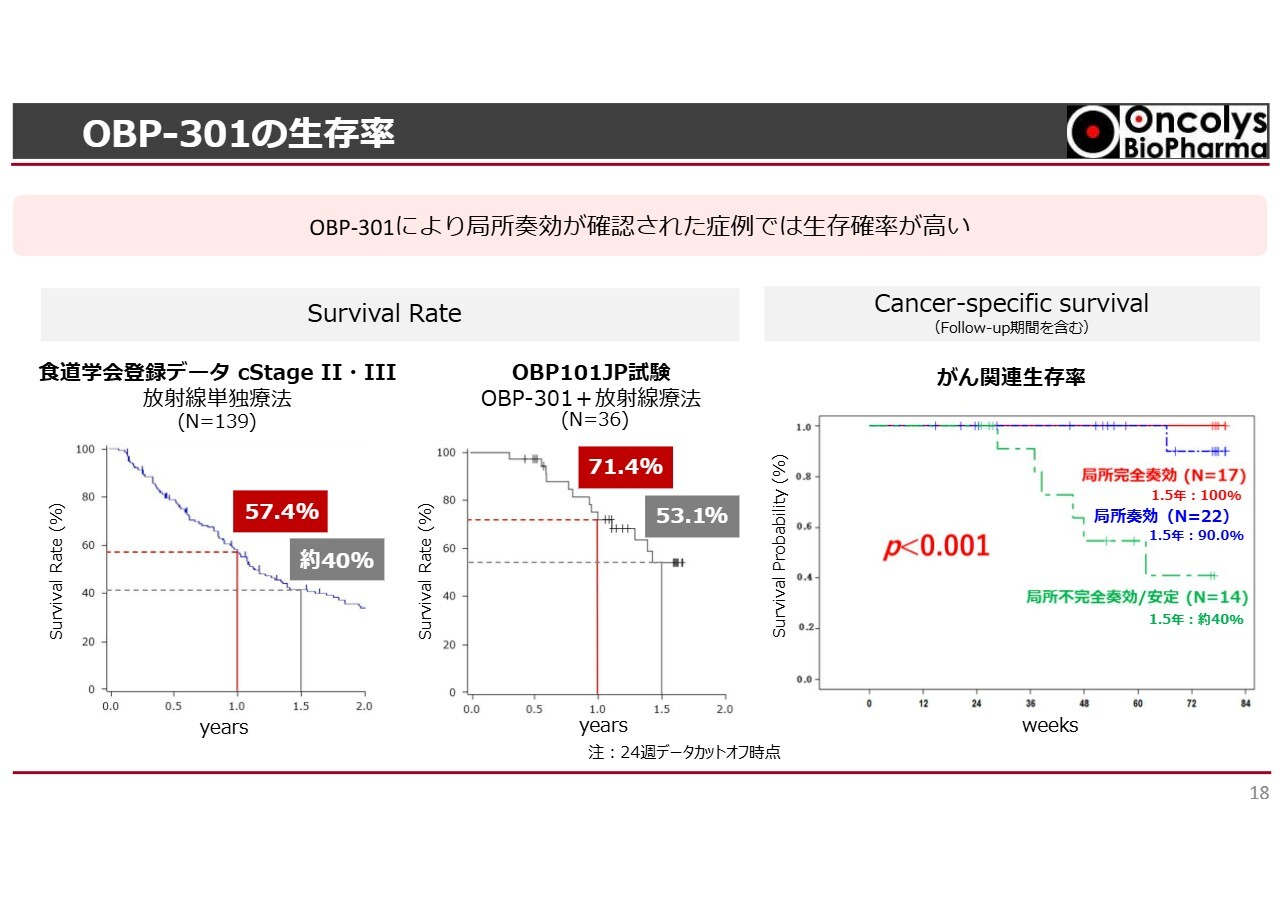
スライド右側のグラフは、主なポイントとなるがん関連生存率を示しています。このグラフのとおり、今回、半数近くの方が完全奏効しました。このような患者群を追跡した結果、赤字で書かれているとおり、1年半経過後でも100パーセントの生存率が確認されるという結果が得られています。
一方で、残りのおよそ50パーセントの方々は、徐々に再発し、お亡くなりになっているケースが見られるため、食道がんでは局所の治療が非常に重要であると考えられます。
また、他の治療法の選択肢がない高齢者や、肝臓や腎臓の状態が良くない患者、放射線治療しか選択肢がない患者に対して、この「テロメライシン」を上乗せすることで、大きなメリットが得られることが明らかになっています。
食道がん放射線併用Phase2試験のまとめ

スライドに記載の内容は、先ほどご説明したとおりです。一番下に記載のある、主な副作用のうちの1つに、風邪のような症状があります。例えば、発熱や体がピリピリするといった症状が約半数の方に出ます。
また、リンパ球数が低下するという副作用もあります。これは無症状であり、リンパ球数は低下しますが、好中球や全体の白血球数にはほとんど変化がありません。
このため、生体の全体的な免疫力を損なうことなく治療が行えていることも確認できています。
OBP-301の海外臨床試験

海外についてです。アメリカのメモリアル・スローン・ケタリングがんセンターは、ニューヨークで最も有名ながんセンターの1つです。ここで初めてアメリカの食道がん患者に対して、スライドにある「CRT」という治療法、日本でいう化学放射線療法に「テロメライシン」を上乗せした治療をした結果、評価症例13例中13例、すべての症例で局所のがんが消失し、CR(complete remission)が得られました。
一方で、1年生存率は60パーセントで、従来と大きな差はありませんでした。
しかしながら、詳細な分析を行うと、局所再発が見られなかった症例が13例中12例ありました。さらに、局所再発がなかった症例の1年後の割合は92パーセントであり、非常に高い局所効果が示されていることが、この試験で明らかとなりました。
ただし、この試験はPhase1であるため、今後Phase2や大規模な臨床試験については、さらなる議論が必要と考えています。
2つ目に、胃がんにおいて「ペムブロリズマブ」というチェックポイント阻害剤と併用して、2次治療の治験を行っています。MSD社が「ペムブロリズマブ」を治験薬として提供し、当社は治験施設に「テロメライシン」を提供するという、医師主導の治験を実施しています。
半年前の報告時点では6例の組み入れ状況でしたが、その後5例が組み入れられ、目標である13例のうち11例まで投与が開始されています。
これが目標症例数に達し、13例中2例または3例が確実にレスポンスを示している場合、1次治療としての「ペムブロリズマブ」+化学放射線療法が効かなかった患者に対しレスポンスが得られたということで、非常に意義深いことになります。
そのため、今後、胃がんの臨床試験をどのように進めていくかについて、大きな判断を年内に行える可能性が出てきたと考えています。
続きまして、この「テロメライシン」の今年の販売開始という大きな目標に向け、現在の進捗状況を久保田執行役員よりご報告します。
安定供給に向けた生産計画
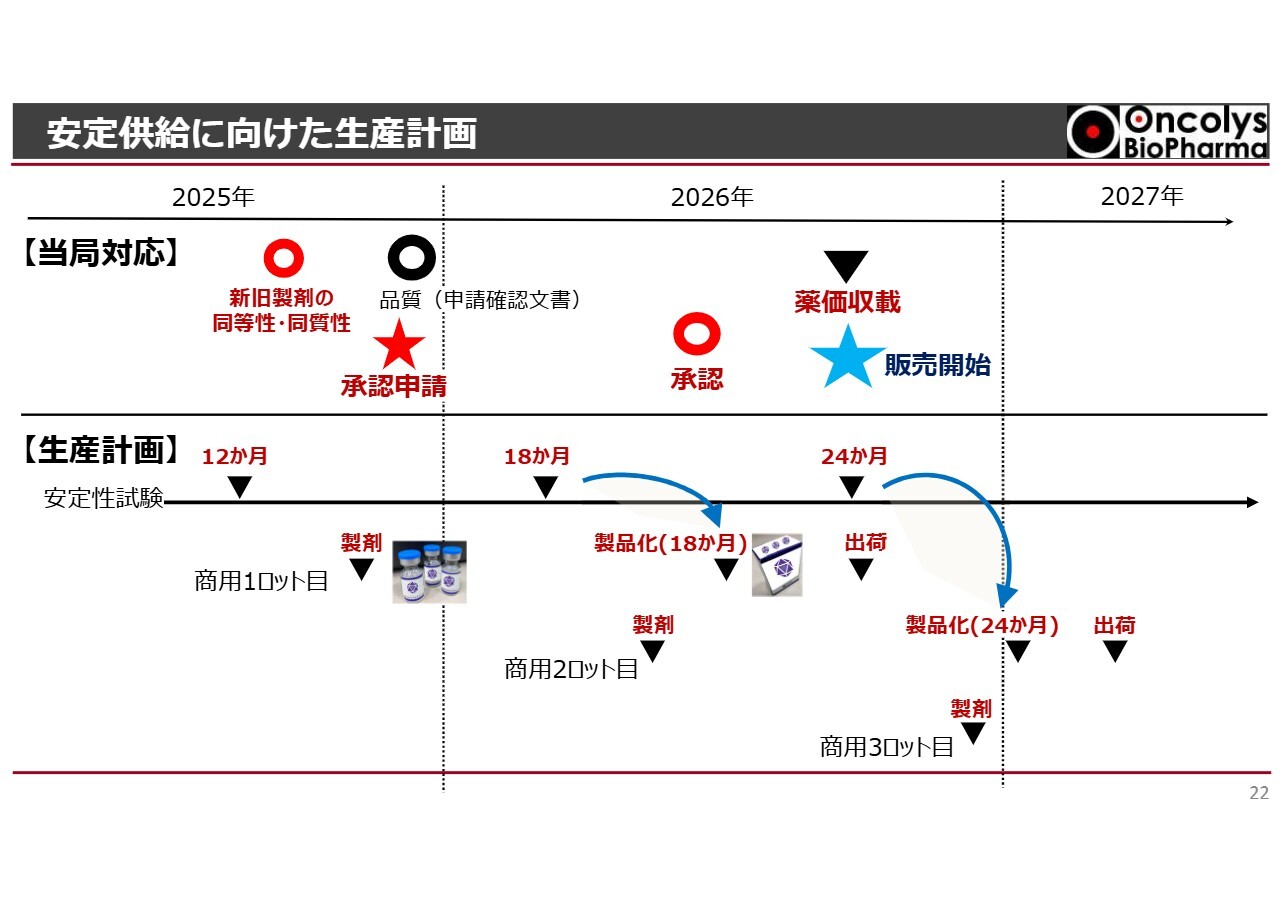
久保田俊之氏(以下、久保田):執行役員の久保田です。私からは販売開始に向けた活動についてご説明します。
1つ目は、安定供給に向けた生産計画です。生産計画のご説明の前に、その前提となる当局の対応についてお話しします。
昨年ご報告したとおり、商用の新製剤について治験時に使用した製剤との同等性および同質性の確認を行いました。この課題をクリアしたことにより、当初の計画であった12月15日に承認申請を行うことができました。
承認申請をしたことにより、2026年中頃に製造販売承認を得ることを想定しています。また、その数ヶ月後に薬価収載があり、販売が開始されるというスケジュールに基づいて、生産計画を立てています。
生産計画については、安定性試験を進めています。先日ご報告したとおり、18ヶ月での安定性が確認されました。
そのため、商用1ロット目については、薬価収載と同時に出荷ができるよう準備を進めており、18ヶ月の有効期限をもって出荷する計画です。
商用2ロット目についても、今年製剤化を進めており、24ヶ月の有効期限をもって出荷できるよう手配を進めています。
商用3ロット目は、2026年内に製造を開始する計画です。
サプライチェーンの整備状況
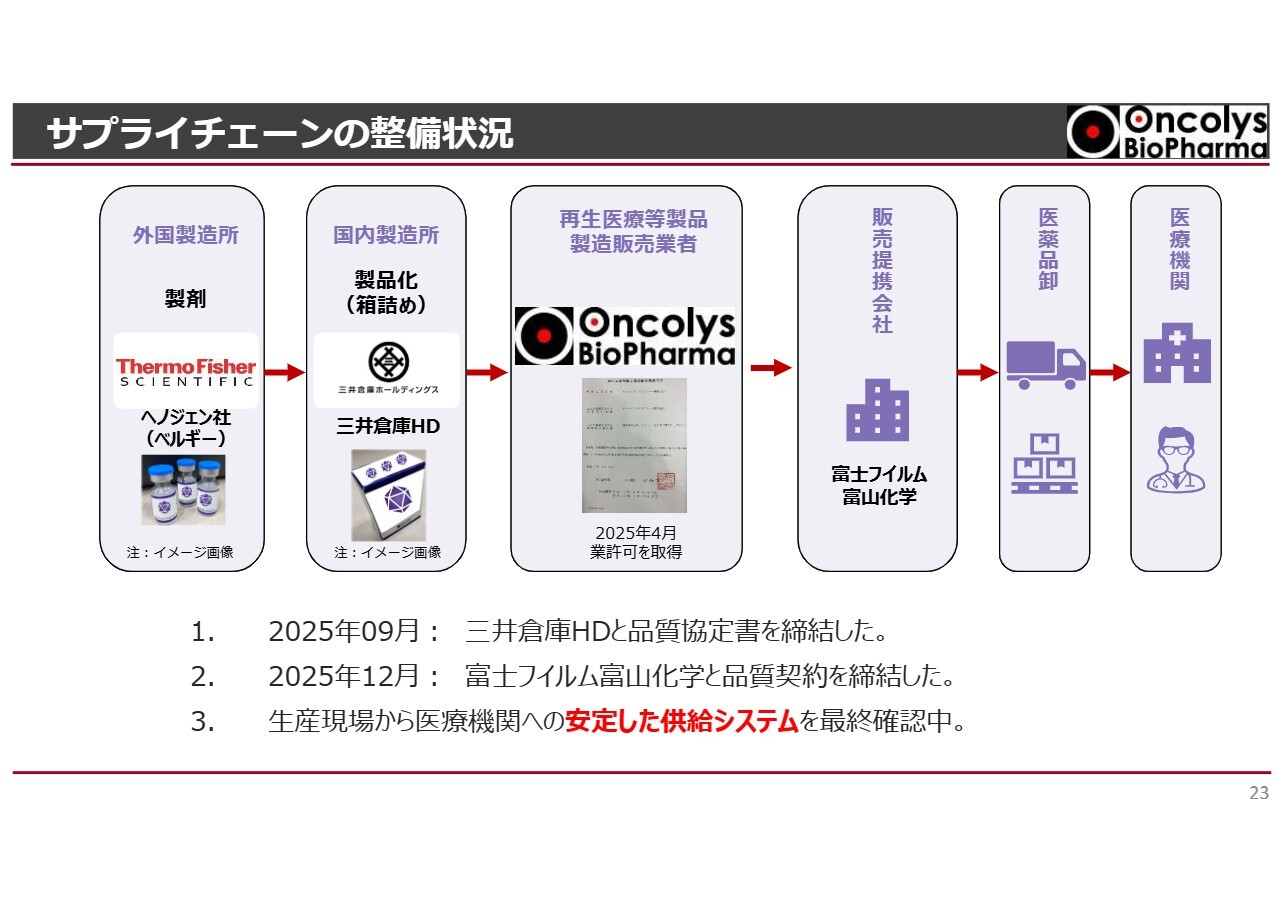
サプライチェーンの整備状況についてご説明します。これまで何度もお話ししていますが、当社の製品「テロメライシン」は、ベルギーに拠点を置くヘノジェン社によって製造されています。
製造された製品はベルギーから国内に輸送され、国内で箱詰めされた後、販売提携会社である富士フイルム富山化学と卸業者を通じて、医療機関に届けられるというサプライチェーンを構築しています。
昨年ご報告のとおり、品質に関しては三井倉庫ホールディングスおよび富士フイルム富山化学と契約を締結済みです。
現在もテストを繰り返しながら、製造所から医療機関へ届ける輸送システムについて、安定したシステムの確立が進み、最終確認作業を行っています。
販売体制の整備計画
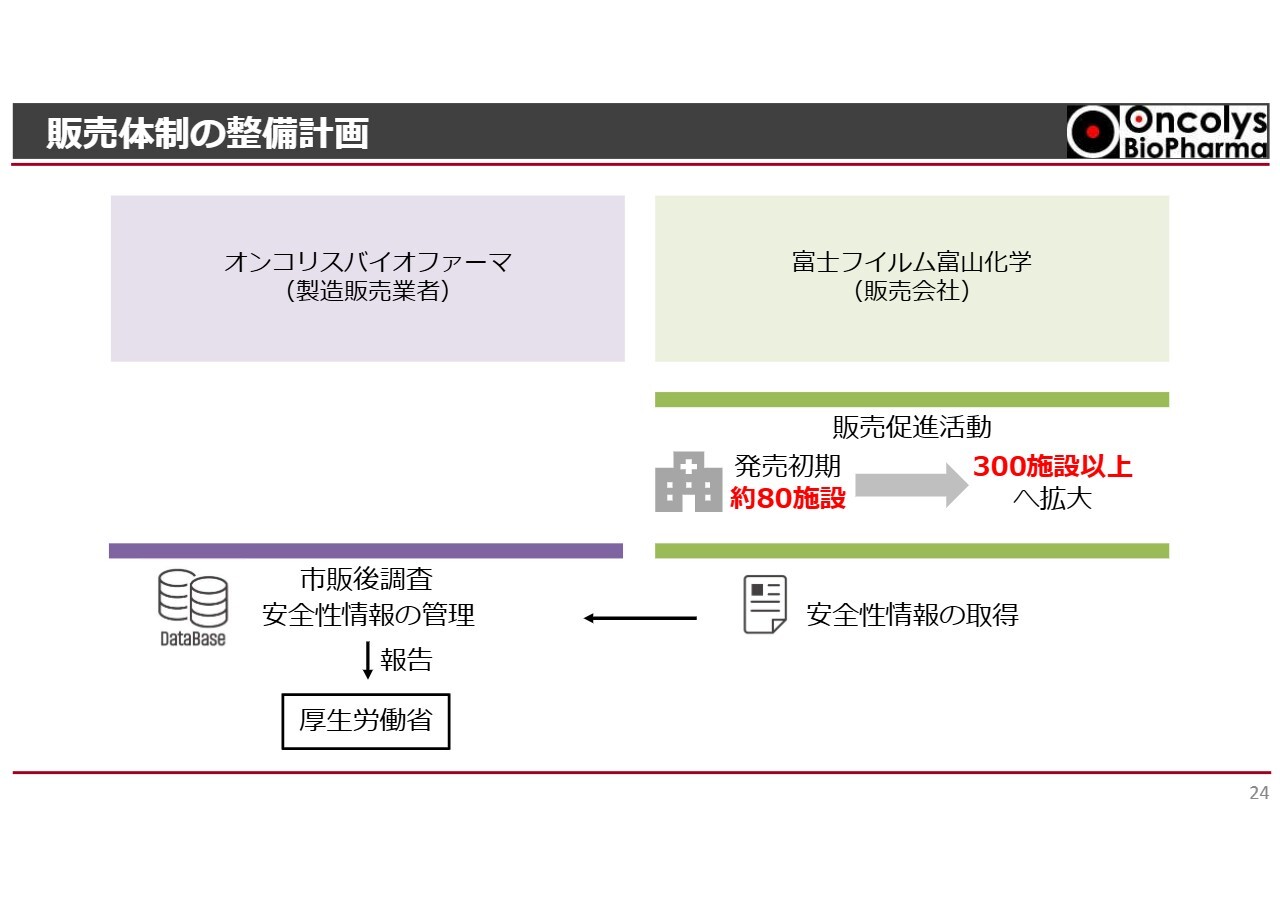
販売体制の整備計画についてご説明します。当社オンコリスバイオファーマは、製造販売業者として「テロメライシン」を発売する予定です。先ほどのスライドで示したとおり、富士フイルム富山化学と販売提携契約を結び、医療機関への配送は販売会社である富士フイルム富山化学が担当します。
富士フイルム富山化学による販売活動を通じて、より多くの食道がん患者にこの薬を届けられると信じており、協力して販売体制を整備しています。
販売促進活動は富士フイルム富山化学が担当します。販売初期には、食道がん患者が多くいらっしゃる約80施設に絞り、「テロメライシン」を適切に使用できるように販売促進活動を行います。その後、対象を300施設以上に拡大し、治療を必要としている全国の患者に薬を届けられるよう準備を進めていきます。
市販後調査や安全性情報の管理については、両社で連携して行います。実際の販売活動において医療現場で得られる患者の副作用などの安全性情報は、富士フイルム富山化学からオンコリスバイオファーマに報告されます。オンコリスバイオファーマがこれらの情報を管理し、厚生労働省へ報告するという体制で進めていきます。
OBP-301の営業戦略

「テロメライシン」の営業戦略についてお話しします。1つ目は、高い薬価を目指す戦略です。
現在のところ、薬価はまだ決定していません。ヘノジェン社での製造など、製造上における外注先の原価開示率を最大化することを目指しています。この最大化によって、先駆け加算やオーファン加算、そして有用性加算などを取得することを目指し現在取り組んでいます。
2つ目は、マーケット展開についてです。当社の製品は、ご存じのとおり、遺伝子改変およびウイルス製剤という製剤です。
治験時には患者への投与に際して施設の負担が大きい治療であったため、長年にわたり準備と検討を進めてきました。
その結果、カルタヘナ運用方法について、医療現場での簡便性を確保することができました。
実際に、患者が外来通院でこの治療を受けられるようにし、施設の負担を軽減することを目指し、実臨床での販売活動につなげていきたいと考えています。
3つ目は、「テロメライシン」のブランディングについてです。この「テロメライシン」は、最初に食道がんをターゲットに承認申請を行っています。
食道がんの治療はまだ治療選択肢が少なく、先生方がご報告されているとおり、5年生存率も高くはありません。
しかし、この「テロメライシン」を活用し、局所でがんを抑えることによって、患者の予後をさらに改善できると信じ、私たちは患者に届ける活動を進めています。
この中で、昨年からスタートした「食道がん局所療法研究会」があり、先生方とともに「局所療法でどれだけ患者さんに貢献できるのか」について議論を行っています。
そのため、この取り組みを継続し、患者により適切に届けられるよう議論を進めていきます。
食道がんでは、まずは高齢者や手術が困難な患者、放射線治療のみを行う患者に使用されることになりますが、それ以外にもこの治療が適する患者がさらにいらっしゃると考えています。
また、放射線との併用だけでなく、その他の治療との組み合わせについても拡大し、より多くの患者に使用されるよう効能の拡大を目指します。
さらに、食道がん以外のがん種にも効能を広げ、より多くの患者にこの薬を届けられるよう、私たちは貢献していきたいと考えています。
OBP-301のビジネス展開

樫原:私からは、「テロメライシン」のビジネス展開についてご説明します。これまで日本での展開についてご説明しましたが、2024年には富士フイルム富山化学と提携し、国内の販売体制がかなり整ってきていることは、先ほど久保田がご説明したとおりです。
今後は、これを海外に展開することについてご説明します。スライドにも記載のとおり、今年は少なくとも1社との提携契約を完了させることを目標にしていきたいと考えています。
また、日本で「テロメライシン」が承認されたという事実が夏以降に出てくる見込みですが、商品パッケージなどを活用して販売していけるアジア諸国を、まずはターゲットにしていきたいと考えています。
台湾、韓国、タイ、マレーシア、ベトナム、シンガポールなどが挙げられていますが、2024年には長年当社と提携しているMedigen社に台湾の権利を許諾し、現在Medigen社では台湾での申請・承認をどのように進めるかの調査を行っています。
日本で「テロメライシン」の承認が得られれば、なるべく早く台湾でも販売できるように、Medigen社と協力していきたいと考えています。
また、それ以外の各国についても、これらの国々を幅広くカバーしている企業との提携を進めていきます。
同様に、イギリスを含めたヨーロッパにおいても「テロメライシン」の提携を進めていきます。
特にイギリスでは、「International Recognition Procedure」とスライドに記載があるような制度のもと、日本で承認がなされれば、イギリスでも承認が得られるという仕組みがあります。
一方で、欧州全体をカバーするには、まだ多くの不明点が残されています。したがって、幅広い国々をカバーしている同様の提携会社と交渉を進め、契約を勝ち取っていきたいと考えています。
トランスポゾン社の今後の展開

浦田:私からは、「OBP-601」についてご説明します。こちらに関しての状況は前回の報告からあまり変わっていませんが、Transposon社の資金調達が今年に入って少し進展してきたようです。
今年の上半期にはファイナンスを完了させ、特にPSP(進行性核上性麻痺)という難病に対する最終的な臨床試験であるPhase3試験を開始する可能性が出てきました。
また、資金調達によりALS(筋萎縮性側索硬化症)という難病に対して、「ヒーリーALSプラットフォーム」を活用したPhase2/3試験を開始する予定です。
ここで良い結果が出れば承認申請に進める可能性があり、FDAともすでに話し合いが進んでいます。こうした最終段階の試験に向けて前進している状況です。
また、アルツハイマー病に関しては、昨年アルツハイマー病創薬財団の資金を獲得しており、いよいよ製剤を準備してPhase2の臨床試験を開始する予定になっています。
このような状況から、将来良い結果が得られた場合には、Transposon社が大手製薬企業に再ライセンスを行う可能性や、M&Aという選択肢も考えられます。
Transposon社については、この1年間ほど大きな進捗はありませんでしたが、ようやくアメリカの状況も落ち着き、資金調達が可能となり、いよいよ今年は本格的に動き出すという状況になっていると聞いています。
安定供給に向けた生産計画
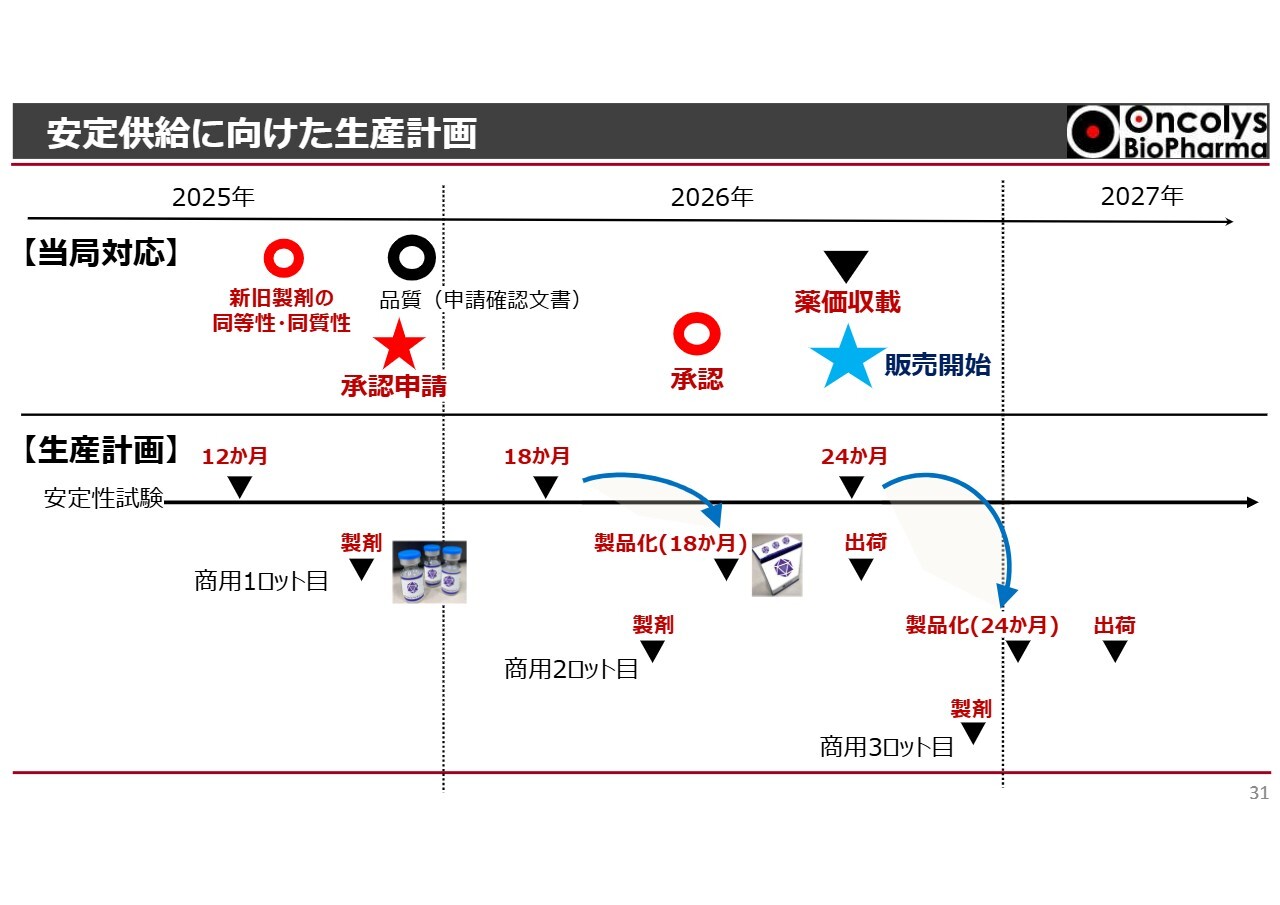
スライドは当社の状況を示しています。主なパイプラインについてご報告しましたが、特に「テロメライシン」については、私も創業以来注力してきました。先ほどお話ししたとおり、昨年12月15日に承認申請を行い、このまま進めばゴールデンウィーク前後にPMDAの審査が終了し、部会へのバトンタッチが行われます。
特に大きな問題がなければ、今年半ばに承認が得られる見込みです。当社としては、現段階で条件付きではなく通常承認を目指しており、その方向でPMDAと協議を進めています。
これが達成できれば、おそらく夏から秋になる前には薬価収載に持ち込めるのではないかと考えています。この薬価収載については、食道がんの局所治療薬やアデノウイルス製剤は世界でもまだ存在しておらず、当社が初めて提供するものとなります。
世界初の製品であることから、当社としては原価に加え、さまざまな加算を見込んで、できる限り高薬価を目指したいと考えています。
薬価収載が決まると、一定期間内に販売を開始しなければならないため、その準備を今年に入ってから進めています。具体的には、どのような販促資材を使用するか、また、各施設でこの薬を納入できるかどうかの審査を進めていきます。
これらの取り組みをできる限り早く前倒しで実施し、販売開始に向けた準備を進めていきたいと考えています。
「2025年にご期待頂きたい事項」の結果

先ほど冒頭でもお話ししましたが、2025年にみなさまにご期待いただきたい事項に関して、「テロメライシン」についてはすべてクリアすることができました。
一方で、Transposon社に導出した「OBP-601」については未達成に終わりました。これについては、今年ご期待いただきたい事項として次のスライドに列挙しています。
「2026年にご期待頂きたい事項」

スライドの1番目に記載のとおり、まず、「テロメライシン」の製造販売承認を取得するために、最大限の努力をしていきたいと考えています。
2番目に記載の薬価収載については、先ほどお話ししたとおりです。
3番目に記載の販売開始については富士フイルム富山化学の協力が必要になりますが、事前に十分な話し合いを行い、スムーズな「テロメライシン」の販売開始を実現し、できる限り早期に施設を増やしていきたいと考えています。
4番目に記載の18ヶ月の製剤安定性試験はすでにクリアしており、この件については問題ありません。
5番目に記載の24ヶ月の安定性試験については、半年後になりますが、こちらもクリアできるのではないかと考えています。
6番目に記載の効能拡大試験も開始します。これについては肛門がんや下部直腸がんを中心に、食道がんも対象としています。当社としては、フランチャイズ的な立場を確立したいと考えています。具体的には、化学放射線治療などによって一時的に消失したものの再発した食道がんに使用可能かどうかを検討しています。
また「テロメライシン」は、現在放射線単独で3回投与を行っていますが、4回目にも使用できるかどうか、さらに、非常に早期の患者にも使用できるかどうか、これらについてもチャレンジしていきたいと考えています。
「OBP-601」については、昨年と同様の目標を設定しています。7番目に記載のとおり、少なくとも1つのピボタル試験、特にPSPのPhase3試験の準備が進捗しています。この試験についてはFDAも認識しており、開始できれば当社はマイルストーン収入を受領できると考えています。
また、8番目に記載のアルツハイマー病における試験を開始することが大きな進展になると考えています。
次に9番目に記載の「OBP-702」についてですが、いよいよFirst In Human(初めて人に投与する試験)が岡山大学で準備されています。すでにPMDAとも何度も協議を行っています。
膵臓がんを対象とした投与が年内に開始される予定です。以上が、みなさまに期待していただきたい事項になります。これら9つの進捗に関して、当社は全力を尽くし、達成したいと考えています。
“Next Door” ~新たな展開へ~
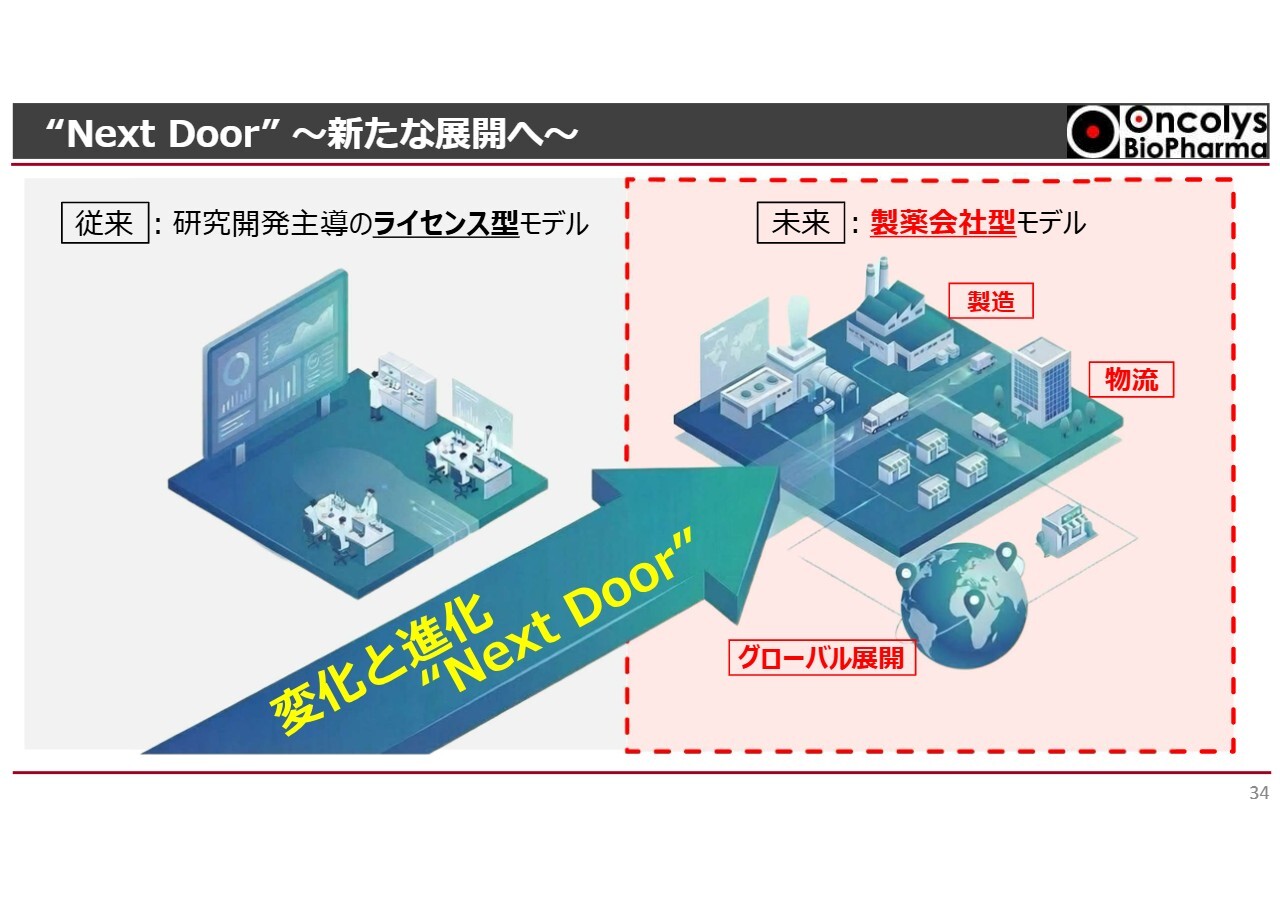
当社はこれまで、研究開発主導のライセンス提供を行うという、いわゆるバイオベンチャーモデルで事業を展開してきましたが、2026年は「“Next Door” ~新たな展開へ~」をスローガンに掲げています。
このスローガンのもと、製造、物流、グローバル展開、さらにパイプライン全体の研究開発を含めた販売までを視野に入れるかたちで、いわゆる製薬会社型モデルへと徐々に転換していきたいと考えています。
これまで研究開発だけを担う会社から、製造や物流、さらには将来を見据えた販売までを可能にするためには、社内体制の大きな変革が必要であり、大きな課題を乗り越えなければならない状況です。
こうした取り組みに対して、当社は「Next Door」というスローガンを掲げ、「新しいドアを開け、新しいオンコリスに向かっていこう」ということで、全社一丸となって努力していきたいと考えています。
以上で、当社の2025年決算に関するご報告を終えたいと思います。ご清聴ありがとうございました。
質疑応答:「テロメライシン」の薬価について
司会者:「『テロメライシン』の薬価に関して教えてください。同じ作用機序ということで、第一三共株式会社の『デリタクト』が参照となるのでしょうか? それともウイルスの種類や対象がん種が違うため、まったく異なる想定と考えたほうがよろしいでしょうか?」というご質問です。
浦田:これについては、さまざまな薬事関係のコンサルタントの方々に意見をうかがっています。意見は2つに分かれています。
当然ながら、当局はあまり詳しいことを教えてくれない状況です。「デリタクト」は脳腫瘍の薬であり、これは腫瘍溶解性のヘルペスウイルスを基にしているため、ウイルスの種類は異なります。
「デリタクト」については、新規性の加算や有用性の加算はなく、条件付き承認での薬価となるため、これらは単純参照されないと考えています。
原価の開示をできる限り高め、有用性加算やオーファン加算、先駆け加算などを見込みながら、原価を基準とした薬価を設定できるよう進めたいと考えています。
また、原価において大きな割合を占めるのはベルギーにあるヘノジェン社です。同社とも協議を行い、可能な限り情報を開示していただけることで合意を得ています。この点についても、なんとか努力を重ねて原価の開示を高めたいと考えています。
質疑応答:「テロメライシン」の資金活用計画について
司会者:「『テロメライシン』の国内承認に関する内容です。条件つき、期限つき承認ではなく、通常承認となった場合、市販後臨床試験のために調達していた資金はどの分野に使途変更されるのでしょうか?」という質問です。
浦田:2025年の資金調達の検討時には、いわゆる市販後の治験を行うことを条件とした承認が想定されていました。この場合、金額は合計4億円から5億円程度を想定していました。しかし、通常承認となれば、その試験を行う必要がなくなるため、この資金を「テロメライシン」の幅広い効能追加に充てたいと考えています。
また、先ほどお話ししました「OBP-702」についてですが、岡山大学で医師主導の膵臓がんの臨床試験を行う予定です。それ以外に、オンコリスが企業治験として行う治験も計画しています。
現時点ではどの領域にするかはお伝えできませんが、この資金を発展的な開発に活用していきたいと考えています。
質疑応答:カルタヘナ法の条件変更による影響について
司会者:「昨年12月にリリースされたカルタヘナ法の条件変更によって、外来通院などにおける想定の採用施設数の上振れは見込めますか?」というご質問です。
浦田:この点については、現在調査中のため「大幅に増える」とはまだ明言しづらいところです。しかし、少なくとも当社が「テロメライシン」用に作成したカルタヘナ運用方式は、外来でも十分に使用できるよう工夫されています。
例えば、内視鏡を投与する際の内視鏡室での防護手段として、目張りを行うことや唾液が飛散した際の対策などについて、非常に詳細に規定されています。これらは「簡便に拭き取れば大丈夫だ」などの状況を含め、国にて正式に認められています。
そのため、増加について現時点で断言はできませんが、非常に受け入れられやすい仕組みが整備されていることは、この段階でお伝えできると考えています。
質疑応答:「テロメライシン」の効能拡大について
司会者:「『テロメライシン』の効能拡大についてです。食道がん対象でのレジメンの広がりについて教えてください。食道がん局所療法研究会の活動状況と今後の予定はいかがでしょうか?」というご質問です。
浦田:食道がん局所療法研究会は、昨年秋の学会シーズンの頃に一度先生方にお集まりいただき、当会の趣旨についてお話ししました。
多くの先生方に賛同いただいており、主に「テロメライシン」の承認申請を行った施設の先生方にご参加いただいています。今年6月、福島県郡山市で開催予定の食道学会の際にも、研究会の一環としてランチョンセミナーを行う予定です。
また、この研究会では医師だけでなく、食道がんの患者会の方々にもご参加いただき、食道がん治療の将来像や理想的な薬の使用方法についてのご意見をうかがえる場にしていきたいと考えています。
今後は、最低でも年に1回はこうした会を開催し、医療現場および患者の声を反映させながら、「食道がんといえば『テロメライシン』」となるような医療状況を構築していきたいと考えています。
質疑応答:「テロメライシン」の食道がん治療におけるファーストライン適用について
司会者:「食道がんの場合、第一選択は手術になりますが、術後の手術痕がつかえとなり、不調を訴える患者さんも多いと聞いています。ファーストラインで手術に代わる療法としての可能性と開発計画はありますか?」というご質問です。
浦田:ご質問のように、オペを行った場合になかなかきれいに治りきらず、さっと飲み込めるようになるわけではないといった声や、内視鏡で摘出した後も瘢痕が残り飲み込みにくいといった声はお聞きしています。
当然ながら、当社もファーストラインにチャレンジしていきたいと考えていますが、いきなり取り組むということは、日本の先生方を説得させる必要があり、現時点ではまだ十分ではないと考えています。
発売後に、先生方に「テロメライシン」の効果や安全性を十分に認識していただいた上で、食道がん局所療法研究会を中心として、「ファーストラインを狙う場合にはどのような試験を組み立てるべきか」を先生方と相談しながら計画を練っていきたいと考えています。
質疑応答:下部直腸がんに関する治験スケジュールについて
司会者:「下部直腸がんに関しての治験スケジュールを教えてください」というご質問です。
浦田:肛門がん等については、現在プロトコルの骨子を作成しており、中心となる先生方のご意見をうかがっています。
肛門がんや下部直腸がんについて、当社の大きな目標は人工肛門をどのように減らすかであり、この点に注力しています。
現在、先生方の意見を集約し、どのようなプロトコルが適切かを最終的に決定しています。今年の上半期には研究会を開催し、治験届を提出し、年内には第一例の投与を開始できるよう計画しています。詳細については、今後正式な報告を行いたいと考えています。
質疑応答:Transposon社の資金調達と進捗状況について
司会者:「『OBP-601』に関して、Transposon社の方針について教えてください。明確に回答いただくことが難しいことは承知していますが、Transposon社の資金調達の状況はいかがでしょうか? また、同社の進捗をどのようにモニタリングしていくのでしょうか?」というご質問です。
浦田:先ほどもお話ししたとおり、資金調達がようやくまとまりつつあると聞いています。私も来月、Transposon社の代表の方と面会する予定で、詳細をうかがってこようと思っています。
資金調達には製薬企業も含まれている可能性があると考えています。こちらはTransposon社の情報ですので、追加の情報が入り次第ご報告します。
臨床試験については準備が整っており、FDAとの協議も完了しています。そのため、資金調達が完了すれば、製剤の製造を非常に早期に開始できる状況、いわゆる「Ready to go」の状態にあると理解しています。
質疑応答:「OBP-702」の今後の展開について
司会者:「『OBP-702』に関して、『OBP-301』と同様に最終治験までオンコリスで手がけるイメージなのか、あるいは途中で導出するイメージなのか、実用化への戦略、考え方をあらためて教えてください」というご質問です。
浦田:「OBP-702」に関しては、現在、膵臓がんを対象に試験を開始しています。これも効果次第では、膵臓がんや当社が企業治験を行う他の対象で非常に顕著な効果が得られた場合には、当然ながらライセンスを視野に入れていきます。
しかしながら、当社は製薬企業としての成長を目指しています。そのため、オーファンドラッグを狙い、臨床試験に多大な費用がかからない領域に注力しつつも、非常に存在感の強い薬を開発していきたいと考えています。
もちろんライセンスも視野に入れますが、できる限り自社で進めていきたいと考えています。
質疑応答:「テロメライシン」のカルタヘナ運用について
司会者:「『テロメライシン』のカルタヘナ運用について、第一種使用ながら外来通院での治療が可能になったのはなぜでしょうか? 投与後一定時間を院内で過ごせば、体外へのウイルス排出がないことを確認できた、あるいは局所投与のためウイルス量が少ないため、生態系に影響しないといえる等のエビデンスを想像していますがいかがでしょうか?」というご質問です。
浦田:当たらずとも遠からぬお考えだと思います。これまでのさまざまな臨床試験において、私たちもウイルスがどこに分布し、どのように体外へ排出されるかを詳細に調査してきました。
最終的に問題となったのは、例えば食道がん患者で口からウイルスを投与する場合です。唾液、咳、痰などにウイルスが含まれる可能性がありますが、非常に短期間でウイルスは消失します。したがって、投与後はしばらくマスクを着用していれば、特に大きな問題はありません。
また、「テロメライシン」を投与すると24時間から48時間ほどウイルスが血液中に出てきます。この期間に例えば怪我や出血があった場合には、絆創膏などを貼って対処します。
さらに、絆創膏を取り替える際には、取り外した絆創膏を袋に入れ、その中に「キッチンハイター」のような塩素系漂白剤を加えた上で、通常のゴミとして廃棄しても問題ないとされています。
アデノウイルス自体はそれほど病原性の強いものではなく、投与によって漏れ出てくる量は非常に希薄です。
便の中にもウイルスが出ることがありますが、現在の下水処理システムは非常に発達しており、その処理過程でウイルスは十分に除去されます。例えば、新型コロナウイルスの時も下水が大きな問題になることはありませんでした。したがって、この点についても確実にクリアできていると考えます。
以上のように、すべてを詳細には説明し切れてはいないものの、生態系に影響はないと考えています。そして、その対処法についても明確に示したことで、カルタヘナ運用が非常にスムーズになったといえます。
質疑応答:研究開発費の見通しについて
司会者:「研究開発費の見通しとして、今期は増えるのでしょうか? 主に肛門がんなど効能拡大に入る時期を考えると下期に増えるのでしょうか?」というご質問です。
秦:研究開発費について、2025年12月期の実績は、先ほど説明したとおり約14億7,000万円でした。
ヘノジェン社での製法開発が中心であり、上半期の研究開発費は10億円ほどありました。その結果、2025年の研究開発費は上半期と下半期で約2対1の割合となりました。
2026年の研究開発費の具体的な金額は非開示ですが、ヘノジェン社での製法開発が一段落したことを考慮すると、結果的に2025年を下回る水準で2026年の研究開発費が着地すると考えています。
質疑応答:「テロメライシン」の安定性に関する今後の報告について
司会者:「『テロメライシン』について、安定性試験のデータは現在も蓄積されているとのことですが、18ヶ月、24ヶ月のデータはどこかのタイミングで新たに当局へ追加で提出し、なんらかの審査を受けるご予定でしょうか? あるいは、12ヶ月までの安定保管を可能にした食品添加物は治療薬との同等性に影響しないとのことでしたので、安定性試験の結果は、今後申請フローには追加されないのでしょうか?」というご質問です。
浦田:この製剤の安定性に関しては、当社のみならず、厚生労働省やPMDAも非常に注視しています。すでに18ヶ月のデータは昨日、PMDAに報告しました。今後、24ヶ月のデータが出た際には、PMDAを通じて厚生労働省に報告することになっています。
それ以降についても、当然報告を進めていきます。特に大きな問題がない限り、審査が行われ、同等性や安定性の面で問題がなければ、通常の商業活動を行ってよいとの判断に至るのではないかと考えています。
質疑応答:「テロメライシン」の販売施設拡大について

司会者:「『テロメライシン』の販売促進活動のご説明で、300施設以上への拡大とありましたが、その納入時期はいつごろを見込んでいますでしょうか?」というご質問です。
久保田:「300施設」というのは、現在日本で食道がんの治療を実施している施設の多くを占める数字です。この目標に向け、私たちは5年以内に300施設への提供を目指し、準備を進め、口座開設を推進していきたいと考えています。
また、放射線治療にこの治療を加えたいと希望する患者さまがいらっしゃる施設を優先し、口座開設を進める予定です。できる限り計画を前倒しし、利用可能な施設を増やしていくことが、私たちの取り組むべき方針であると考えています。
質疑応答:他社との競合について
司会者:「『OBP-301』の開発対象として膀胱がん、特に筋層非浸潤性膀胱がんは含まれるのでしょうか?
浦田:アメリカのCGオンコロジー社が、キッセイ薬品工業株式会社とともに腫瘍溶解アデノウイルスのPhase3を進めています。
当然ながら、当社の腫瘍溶解アデノウイルスにとって、膀胱がんも対象になると考えています。ただし、あまり良い表現ではないかもしれませんが、他社との住み分けをある程度考えたほうが、直接競合するよりも良いのではないかと思っています。
このご質問には直接関係しませんが、当社も昨年の成果として、内視鏡でがんの局所に腫瘍溶解アデノウイルスを投与するという非常にクリティカルな特許を取得しています。
したがって、少なくとも、他社が食道がんや胃がんなど内視鏡で投与が必要な領域に参入することが難しいという状況を作っています。
そのような意味では、住み分けがあるのではないかと考えています。現段階では、膀胱がんを狙う状況にはまだ至っていません。
質疑応答:「OBP-301」の海外展開について
司会者:「『OBP-301』の海外展開についてお尋ねします。『OBP-301』の販売を委託する海外企業を今年中に1社見つけるという理解でよろしいでしょうか? また、アジア、欧州での提携先との交渉状況を教えてください」というご質問です。
樫原:1社を見つけるという認識で合っています。交渉状況に関しては、詳しい内容をお話しすることは難しいのですが、日本で承認が明確になるタイミングにおいて、海外での販売提携の可能性が高まると考えています。
そのような企業をいくつか見つけ、なんとか今年中に1件と契約締結したいと考えています。
浦田氏からのご挨拶
浦田:本日もたくさんのご質問をいただき、誠にありがとうございました。当社はようやく承認申請を通過し、「テロメライシン」の製造販売承認に向かって進んでいます。
日本にはたくさんのバイオベンチャーがありますが、承認を取得し、販売まで持っていくという大きなハードルを越えるベンチャーは多くはありません。当社もその中に加わり、今年は大きな飛躍を遂げたいと考えています。
本日は誠にありがとうございました。今後ともよろしくお願い申し上げます。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
4588
|
2,182.0
(15:30)
|
+22.0
(+1.01%)
|
関連銘柄の最新ニュース
-
オンコリス(4588) 2025年12月期決算説明会 書き起こし記... 今日 17:00
-
東証グロース(前引け)=値上がり優勢、窪田製薬HDがS高 今日 11:33
-
東証グロ-ス指数は反発、主力市場に関心向かう 02/09 17:05
-
東証グロース市場250指数先物概況:衆院選を受け反発も上値は限定的 02/09 16:30
-
決算プラス・インパクト銘柄 【東証スタンダード・グロース】引け後 ... 02/09 15:51
新着ニュース
新着ニュース一覧-
今日 18:50
-
今日 18:45
-
今日 18:45

